з хімії «Історія одного речовини: звеселяючий газ»
|
Скачати 19.02 Kb.
|
|
| Дата конвертації | 26.11.2018 |
| Розмір | 19.02 Kb. |
| Тип | реферат |
|
|
-
Навігація по даній сторінці:
- РЕФЕРАТ ПО ХІМІЇ
- Мета
- Оксид азоту (I)
|
Державне загальноосвітній заклад середня загальноосвітня школа № 325 Фрунзенського району Санкт-Петербурга РЕФЕРАТ ПО ХІМІЇ «Історія одного речовини: звеселяючий газ» Роботу виконала учениця 9 «А» Рузанова Анастасія Науковий керівник: Рогова Є. В. Науковий консультант: Головко Н. В. Санкт-Петербург 2011р. утриманні е 1. Введення ............................................................ ... ... .... ... .3 2. Багатолике речовина. ........................................... ...... .. ... ..4 3. Історія відкриття ................................................... .. ... ... 5-6 4. Будова молекули .............................................. ....... .... ... 7 5. Фізичні властивості ................................................. ... ... ... 8 6. Хімічні властивості .................................. ............. .... ...... .9 7. Отримання ............................................................. ... ... 10-11 8. Застосування ................................................ .. ............... 12-13 9. Цікаві факти ................................................... .. ... 14-16 10. Висновок ............................................................. .... ... .17 11. Інформаційні джерела ........................................... ... 18 12. Додаток ................................................................ ... .19 Вступ Звеселяючий газ - одне із з'єднань азоту. Найчастіше дана речовина використовується в медицині і автомобільної промисловості. Але в повній мірі можливості закису азоту ще не досліджені. Ця робота може бути цікава різнопланової аудиторії. Адже кожен з нас чув словосполучення звеселяючий газ, і нам здається, що кожному б хотілося про нього побільше дізнатися: фізичні властивості, хімічні. У цій реферативной роботі представлені різні цікаві факти, наприклад: не кожен знає, що закис азоту є в Мотиль. Даною роботою ми спробували відкрити завісу над одним з найцікавіших хімічних сполук - звеселяючий газ. Мета: Проаналізувати особливості, хімічні, фізичні властивості і застосування звеселяючого газу. завдання: 1. Проаналізувати літературу і джерела в інтернеті по даній темі. 2. Вивчити історію відкриття звеселяючого газу. 3. Дослідити види застосування закису азоту. багатолика РЕЧОВИНА 1) Оксид азоту (I) ІСТОРІЯ ВІДКРИТТЯ Відкриття звеселяючого газу було скоєно при дослідженні солоного озера Дон-Жуан а Антарктиці. Концентрація солі тут досягає 40%, це саме солоне озеро в світі. Для порівняння: в водах Мертвого моря її міститься тільки 30%. Звеселяючий газ в Дон-Жуар утворюється в міру того, як багата нітритом солона вода вступає в реакцію з вулканічними породами, що містять залізо. Ця проста реакція, ймовірно, також відбувається і в багатьох інших подібних місцях. Джой припустив, що подібна реакція може добувати газ на Марсі. Реакція, яка генерує закису азоту має специфічну ізотопну підпис. «Цей метод може бути легким способом виявлення атмосфери Червоної планети і виявлення областей, під поверхнею, де відбувається мікробне життя», говорить дослідник, за даними журналу New scientist. Т БУДОВА МОЛЕКУЛИ
 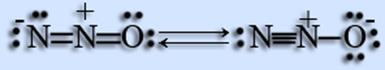  ФІЗИЧНІ ВЛАСТИВОСТІ Безбарвний негорючий газ, важчий за повітря (відносна щільність 1,527), з характерним солодкуватим запахом. Розчином у воді (0,6 обсягу N 2 O в 1 об'ємі води при 25 градусів). При 0 градусів і тиску 30 атм, а також при кімнатній температурі і тиску 40 атм згущається в безбарвну рідину. З 1 кг рідкого закису азоту утвориться 500 л газу. Нащо, але підтримує горіння. Звеселяючий газ єдине не отруйна речовина Суміші з воднем, аміаком або окисом вуглецю і деякими іншими горючими речовинами при нагріванні вибухають; з водою, розчинами кислот і лугів не реагує, кисень не окислюється. При нагріванні до 500 градусів помітно, а при 900 градусів повністю розкладається на азот і кисень (див. Додаток № 1). ХІМІЧНІ ВЛАСТИВОСТІ Відноситься до несолеобразующіе оксидів. Оксид азоту (I) не взаємодіє з водою. У нормальних умовах N 2 O хімічно інертний, при нагріванні проявляє властивості окислювача: N 2 O + H 2 = N 2 + H 2 O 2N H 2 0 -2e - 2H + в-ль (ок-ся) 2N C 0 -2e - C +2 в-ль (ок-ся) При взаємодії з сильним окислювачами N 2 O може проявляти властивості відновника:
5 2N 8 Mn
2
ОТРИМАННЯ Звеселяючий газ виходить з аміачної селітри (нітрату амонію) при розкладанні. NH 4 NO 3 - N 2 O + 2H 2 O
NH 2 SO 2 OH + HNO 3 (73%) = N 2 O + H 2 SO 4 + H 2 O Біологи зробили цікаве відкриття - в травному тракті мотиля був виявлений звеселяючий газ. Справа в тому, що травлення цих комах влаштований так, що практично постійно, нехай і в невеликих обсягах виробляє оксид азоту. Цей факт привернув увагу вчених не тільки тому, що газ може впливати на нервову систему інших тварин, а й тому, що газ впливає на світовий клімат. Тепер вчені мають більш детально вивчити, як цей факт впливає на стан водойми, де мешкає мотиль. Крім того належить з'ясувати чи може обсяг газу виділяється мотилем по всьому світу впливати на процес глобального потепління.
ЗАСТОСУВАННЯ Використовується в основному як засіб інгаляційного наркозу, в основному в поєднанні з іншими препаратами (через недостатньо сильного знеболювального дії).У той же час це застосування майже не буває ускладнень. Також іноді використовується для поліпшення технічних характеристик двигунів внутрішнього згоряння. Закис азоту іноді використовується для поліпшення технічних характеристик двигунів внутрішнього згоряння. У разі автомобільних застосувань речовина, що містить закис азоту, і пальне впорскується у впускний (всмоктуючий) колектор двигуна, що приводить до наступних результатів: Протягом багатьох років звеселяючий газ використовувався в стоматології як своєрідна заміна анестезії - знімав у пацієнтів страх перед зубним лікарем. У 2002 році на спецзасіб звернули увагу в Пентагоні: було зроблено замовлення на дослідну розробку боєприпасів, які паралізують противника приступом сміху. У харчовій промисловості з'єднання зареєстровано в якості харчової добавки Е942, як пропелент і пакувальний газ. Були спроби використання закису азоту в гоночних автомобілях протягом декількох наступних десятиліть, але, оскільки це була закрита галузь досліджень, не надто багато людей знало про її існування. Існують і більш специфічні сфери застосування закису азоту. Так, закис азоту успішно використовується для впорскування в двигуни гоночних автомобілів для збільшення їх потужності, при підготовці аквалангістів до занурення на значну глибину, в атомноабсорбціонной спектрофотометрії, в кріохірургії, в деяких інших областях. ЦІКАВІ ФАКТИ 1) Виявлення молекул забавного газу, або діоксиду азоту в атмосфері Марса, може послужити ще одним приводом для заяви вчених про ймовірне існування життя на Червоній Планеті. "Під час хімічної реакції виділяється водень, який є основним" паливом "для хемосинтезу мікроорганізмів. Отже, якщо ми знайдемо на Марсі частинки діоксиду азоту, то дослідження з пошуку мікробного життя на Червоній Планеті будуть розширені в кілька разів", сказала Джо Менді, співробітник Самаркіна. Зараз вчені мають у своєму розпорядженні 2-ма головними фактами, які розмовляють про ймовірну життя на Марсі: наявність в його атмосфері метану і аква льоду на його поверхні. Метан став цілою загадкою для дослідників. У природі цей газ може утворюватися лише через геологічної енергійності, або в результаті життєдіяльності живих організмів. Але так як діючих вулканів на Марсі не знайдено - означає залишається лише 2-ий варіант. Ну а з приводу наявності аква льоду все просто, він був знайдений декількома марсоходами і орбітальними зондами. 2) Вашингтон, США, Август 31 (Новий Регіон, Володимир Семенов) - Доктор Равішанкара і його колеги з Національного управління океанічних і атмосферних досліджень (NOAA) (США) показали в своїй роботі, що закис азоту, або надзвичайно звеселяючий газ (N 2 0), руйнує озоновий шар навіть з більшою швидкістю, ніж фреони. 3) Глобальне потепління і, як наслідок, відтавання грунту в районах вічної мерзлоти призведе до того, що в атмосфері різко збільшиться кількість закису азоту N 2 O. Закис азоту N 2 O - один з трьох найважливіших парникових газів, що з'являються в результаті людської діяльності, разом з двоокисом вуглецю і метаном. Він входить в число газів, обсяг яких регулюється Кіотським протоколом ООН. Активно виробляється цей вид газу в процесі сільського господарства, особливо з заснованих на азоті добрив. Парниковий ефект від звеселяючого газу в 300 разів більше, ніж від вуглекислого, і нові знання допоможуть в дослідженні проблеми глобального потепління. ВИСНОВОК Проаналізувавши літературу і різні джерела, ми дізналися багато цікавого про таку хімічну речовину. Інформація про те, що оксид азоту був відкритий в 1772 році, але його не відразу застосовували, нас навіть кілька вразило. Також ми дізналися, де застосовується оксид азоту (I). Ми ще дізналися хімічні властивості, з чим реагує N 2 O. Про звеселяючий газ ми дізналися кілька цікавих фактів, про те, що парниковий ефект більше від звеселяючого газу, ніж від озону. Нам здається, що в майбутньому звеселяючий газ буде використовуватися в простих газуваннях, можливо в карамельках, тому що при попаданні в організм людини з'являється п'янкий ефект. ІНФОРМАЦІЙНІ ДЖЕРЕЛА: 1. Ахметов Н.С. Загальна неорганічна хімія, М., «Вища школа» 1988 року, стр.333 2. Валендінская О.Р., МГУ, М. 3. Кузьменько Н.Є., Єрьомін В.В., Попков В.А. Почала хімії, М., 2001 р. 4. Фадєєв Г.Н. П'ята вертикаль, М., «Просвещение» 1985 року стр.58,61 5. Інтернет джерела: 6. Могілевскій.Б., Гемфрі Деві, серія «Життя видатних людей» 2. (Випуск 112) Журнально-газетне об'єднання, М., 1937 р 7. Вікіпедія 8. Медицина Ростова, довідник ліків 9. Наука і інформаційні технології 10. Estestvo-Znanie.ru, Освітній портал про природознавстві 11. Бібліотека юного дослідника Додаток № 1
|
|||||||||||||||||||||||||||
 ак ж в музеї Thackray наводиться коротка історія звеселяючого газу. Вперше закис азоту синтезував англійський учений і філософ Джозеф Прістлі в 1772 році, але його знеболюючі властивості відкрив хімік Хемфрі Деві під час подальших дослідів. Він же і назвав закис азоту "звеселяючим газом", тому що при вдиханні цієї речовини не тільки зникає біль, але і стає дуже весело. Незважаючи на потенціал звеселяючого газу, в медицині його почали застосовувати не відразу, а лише через 40 років після дослідів Деві. Спочатку вчені побратими лише відмахнулися від його відкриття, зате звеселяючий газ відразу ж став цвяхом вечірок. Такі заходи називалися '' ether frolics '' (Ефірні посиденьки) і були популярні не тільки в Англії, але і в США. Подихати звеселяючий газом за невелику плату можна було і під час ярмарків і карнавалів - напевно саме нудне уявлення відразу ж здавалося верхом дотепності. Видатний англійський хімік Хемфрі Деві за допомогою цього газу влаштовував спеціальні сеанси. Ось як описував дію закису азоту один із сучасників Деві: «Одні джентльмени стрибали по столах і стільцях, у інших розв'язалися язики, треті виявили надзвичайну схильність до бійки».
ак ж в музеї Thackray наводиться коротка історія звеселяючого газу. Вперше закис азоту синтезував англійський учений і філософ Джозеф Прістлі в 1772 році, але його знеболюючі властивості відкрив хімік Хемфрі Деві під час подальших дослідів. Він же і назвав закис азоту "звеселяючим газом", тому що при вдиханні цієї речовини не тільки зникає біль, але і стає дуже весело. Незважаючи на потенціал звеселяючого газу, в медицині його почали застосовувати не відразу, а лише через 40 років після дослідів Деві. Спочатку вчені побратими лише відмахнулися від його відкриття, зате звеселяючий газ відразу ж став цвяхом вечірок. Такі заходи називалися '' ether frolics '' (Ефірні посиденьки) і були популярні не тільки в Англії, але і в США. Подихати звеселяючий газом за невелику плату можна було і під час ярмарків і карнавалів - напевно саме нудне уявлення відразу ж здавалося верхом дотепності. Видатний англійський хімік Хемфрі Деві за допомогою цього газу влаштовував спеціальні сеанси. Ось як описував дію закису азоту один із сучасників Деві: «Одні джентльмени стрибали по столах і стільцях, у інших розв'язалися язики, треті виявили надзвичайну схильність до бійки». +1 + 2 e - N 2 0 ок-ль (в-ся)
+1 + 2 e - N 2 0 ок-ль (в-ся) 5N 2 O + 8KMnO 4 + 7H 2 SO 4 = 5Mn (NO 3) 2 + 3MnSO 4 + 4K 2 SO 4 + 7H 2 O
5N 2 O + 8KMnO 4 + 7H 2 SO 4 = 5Mn (NO 3) 2 + 3MnSO 4 + 4K 2 SO 4 + 7H 2 O При нагріванні вище 600 градусів N 2 O розкладається з вибухом:
При нагріванні вище 600 градусів N 2 O розкладається з вибухом: 3 2N
3 2N  Треба помістити невелику кількість селітри в пробірку і закрити пробкою з газової трубкою. Акуратно нагріваємо до температури не більше 200 градусів Цельсія і припиняємо нагрівання при прояві газу з трубки. Газ підтримує горіння і має приємний запах, якщо помістити в банку з закисом азоту палаючу лучину, то вона буде горіти цікавим яскравим полум'ям. Чи не радиться довго вдихати даний газ, оскільки він має сильну дію і використовується в якості наркозу в медицині. Симптомами дії газу є запаморочення,
Треба помістити невелику кількість селітри в пробірку і закрити пробкою з газової трубкою. Акуратно нагріваємо до температури не більше 200 градусів Цельсія і припиняємо нагрівання при прояві газу з трубки. Газ підтримує горіння і має приємний запах, якщо помістити в банку з закисом азоту палаючу лучину, то вона буде горіти цікавим яскравим полум'ям. Чи не радиться довго вдихати даний газ, оскільки він має сильну дію і використовується в якості наркозу в медицині. Симптомами дії газу є запаморочення, 





